PROPIEDADES
DE LA MATERIA
Materia es todo aquello que ocupa un lugar en el espacio, tiene una energía medible y está sujeto a cambios en el tiempo y a interacciones con aparatos de medida. En física y filosofía, materia es el término para referirse a los constituyentes de la realidad material objetiva, entendiendo por objetiva que pueda ser percibida
de la misma forma por diversos sujetos. Se considera que es lo que
forma la parte sensible de los objetos perceptibles o detectables por
medios físicos. Es decir es todo aquello que ocupa un sitio en el
espacio, se puede tocar, se puede sentir, se puede medir, etc.
En física, se llama materia a cualquier tipo de entidad física que es parte del universo observable, tiene energía
asociada, es capaz de interaccionar, es decir, es medible y tiene una
localización espaciotemporal compatible con las leyes de la física.
Clásicamente se consideraba que la materia tiene tres propiedades que juntas la caracterizan: que ocupa un lugar en el espacio y que tiene masa y duración en el tiempo.
En el contexto de la física moderna se entiende por materia cualquier campo, entidad, o discontinuidad traducible a fenómeno perceptible que se propaga a través del espacio-tiempo a una velocidad igual o inferior a la de la luz y a la que se pueda asociar energía. Así todas las formas de materia tienen asociadas una cierta energía pero sólo algunas formas de materia tienen masa.
Nivel macroscópico
Macroscópicamente, la materia másica se presenta en las condiciones
imperantes en el sistema solar, en uno de cuatro estados de agregación
molecular: sólido, líquido, gaseoso y plasma. De acuerdo con la teoría
cinética molecular la materia se encuentra formada por moléculas y éstas se encuentran animadas de movimiento, el cual cambia constantemente de dirección y velocidad cuando chocan o bajo el influjo de otras interacciones físicas. Debido a este movimiento presentan energía cinética que tiende a separarlas, pero también tienen una energía potencial que tiende a juntarlas. Por lo tanto el estado físico de una sustancia puede ser:
- Sólido: si la energía cinética es menor que la potencial.
- Líquido: si la energía cinética y potencial son aproximadamente iguales.
- Gaseoso: si la energía cinética es mayor que la potencial.
- Plasma: si la energía cinética es tal que los electrones tienen una energía total positiva.
Bajo ciertas condiciones puede encontrarse materia másica en otros estados físicos, como el condensado de Bose-Einstein o el condensado fermiónico.
La manera más adecuada de definir materia másica es describiendo sus cualidades:
- Presenta dimensiones, es decir, ocupa un lugar en un espacio-tiempo determinado.
- Presenta inercia: la inercia se define como la resistencia que opone la materia a modificar su estado de reposo o movimiento.
- La materia es la causa de la gravedad o gravitación, que consiste en
la atracción que actúa siempre entre objetos materiales aunque estén
separados por grandes distancias.
Materia no-másica
Todos los cuerpos tienen masa ya que
están compuestos por materia. También tienen peso, ya que son atraídos por la
fuerza de gravedad. Por lo tanto, la
masa y el peso son dos propiedades diferentes y no deben confundirse. Otra
propiedad de la materia es el volumen,
porque todo cuerpo ocupa un lugar en el espacio. A partir de las propiedades anteriores
surgen, entre otras, propiedades como la impenetrabilidad
y la dilatabilidad. |
La materia está en constante cambio. Las transformaciones que pueden producirse
son de dos tipos: - Físicas:
son aquellas en las que se mantienen las propiedades originales de la sustancia
ya que sus moléculas no se modifican. - Químicas:
son aquellas en las que las sustancias se transforman en otras, debido a que los
átomos que componen las moléculas se separan formando nuevas moléculas.
Propiedades generales
Las presentan los cuerpos sin distinción y por tal motivo no permiten
diferenciar una sustancia de otra. Algunas de las propiedades generales
se les da el nombre de extensivas, pues su valor depende de la cantidad
de materia, tales el caso de la masa, peso, volumen, la inercia, la energía, impenetrabilidad, porosidad, divisibilidad, elasticidad, maleabilidad, tenacidad y dureza entre otras.
Propiedades características
Permiten distinguir una sustancia
de otra. También reciben el nombre de propiedades intensivas porque su
valor es independiente de la cantidad de materia. Las propiedades
características se clasifican en:
Físicas
Es el caso de la densidad, el punto de fusión, el punto de ebullición, el coeficiente de solubilidad, el índice de refracción, y las propiedades organolépticas.
Químicas
Están constituidas por el comportamiento de las sustancias al
combinarse con otras, y los cambios con su estructura íntima como
consecuencia de los efectos de diferentes clases de energía.
Ejemplos:
- corrosividad de ácidos
- poder calorífico
- acidez
- reactividad
Ley de la conservación de la materia
Como hecho científico la idea de que la masa se conserva se remonta al químico Lavoisier, el científico francés considerado padre de la Química
moderna que midió cuidadosamente la masa de las sustancias antes y
después de intervenir en una reacción química, y llegó a la conclusión
de que la materia, medida por la masa, no se crea ni destruye, sino que
sólo se transforma en el curso de las reacciones. Sus conclusiones se
resumen en el siguiente enunciado: En una reacción química, la materia no se crea ni se destruye, solo se transforma. El mismo principio fue descubierto antes por Mijaíl Lomonosov, de manera que es a veces citado como ley de Lomonosov-Lavoisier, más o menos en los siguientes términos: La masa de un sistema de sustancias es constante, con independencia de los procesos internos que puedan afectarle,
es decir, "La suma de los productos, es igual a la suma de los
reactivos, manteniéndose constante la masa". Sin embargo, tanto las
técnicas modernas como el mejoramiento de la precisión de las medidas
han permitido establecer que la ley de Lomonosov-Lavoisier, se cumple
sólo aproximadamente.
La equivalencia entre masa y energía descubierta por Einstein
obliga a rechazar la afirmación de que la masa convencional se
conserva, porque masa y energía son mutuamente convertibles. De esta
manera se puede afirmar que la masa relativista equivalente (el total de masa material y energía) se conserva, pero la masa en reposo puede cambiar, como ocurre en aquellos procesos relativísticos en que una parte de la materia se convierte en fotones. La conversión en reacciones nucleares
de una parte de la materia en energía radiante, con disminución de la
masa en reposo; se observa por ejemplo en procesos de fisión como la
explosión de una bomba atómica, o en procesos de fusión como la emisión constante de energía que realizan las estrellas.
Las
características de la materia se dividen en dos grupos acordes a cada
cualidad en particular, los dos grupos que se forman son:
PROPIEDADES EXTENSIVAS
PROPIEDADES INTENSIVAS
PROPIEDADES EXTENSIVAS
- Propiedades
extensivas llamadas también generales, como su nombre lo indica,
están basadas en función de la cantidad de materia a considerar, es
decir, si nos proponemos a medir una canica de vidrio que tiene
una masa de 30 gr, y la comparamos con un cayuco de vidrio también
de forma esférica, este último tendrá una masa mucho mayor aunque
se trate del mismo material.
Algunos
ejemplos de estas propiedades son el peso, volumen, longitud, masa
etc., como puedes ver todas ellas dependen de la cantidad de materia a
medir
Peso:
es la relación existente entre la fuerza de atracción que ejerce la
tierra sobre determinada cantidad de masa, este depende de la fuerza de
gravedad, la posición relativa y la masa de los objetos. La unidad de
medida del peso es el Newton
Volumen: el volumen es
una magnitud física derivada, se define como el espacio que ocupa un
cuerpo en el universo, las unidades para medirlo son el metro cubico,
centímetro cubico, litro, mililitro.
Longitud: la longitud se es una magnitud
que mide la distancia entre dos puntos, también puede considerarse
como la medida de cada una de las dimensiones de un cuerpo: la unidad de
medida de la longitud en el sistema métrico decimal es el metro
Masa:
la masa de define como la cantidad de materia que contiene un cuerpo,
en muchas ocasiones se confunden los términos de masa y peso y esta
última es una unidad de fuerza a diferencia de la masa que es una
magnitud escalar, la unidad de masa en el sistema internacional de
unidades es el kilogramo
PROPIEDADES INTENSIVAS
- Propiedades
intensivas o específicas: son las características de la
materia que son independientes de la cantidad a medir, no importa
la cantidad pues estas propiedades siempre permanecen constantes,
no son aditivas, en muchos casos son el resultado de dos
propiedades extensivas, como es el caso de la densidad que es la
relación que existe entre masa y volumen, algunas otras propiedades
son: Punto de fusión, Punto de ebullición, Densidad, Coeficiente de solubilidad, Indice de refracción entre otros
Densidad: se define a esta como la
relación existente entre la cantidad de materia que posee un cuerpo y el
espacio que esta ocupa (relación de masa entre volumen), D=m/v la unidad de medida de la densidad es Kg/mt3, gr/cm3, la densidad es una magnitud intensiva.
Punto de ebullición: en un
sistema líquido se considera el punto de ebullición a la temperatura en
donde la presión de vapor del líquido es igual a la presión del medio
que rodea al líquido. Cuando se cumple esta
condición, se forma vapor en cualquier parte del líquido, en otras
palabras el punto de ebullición es la temperatura en donde el estado
líquido pasa a estado gaseoso o al revés.
Punto de fusión: esta
propiedad intensiva se refiere a la temperatura en la cual el estado
sólido y líquido de una sustancia coexisten en equilibrio térmico, esto
es a una presión de una atmósfera
Coeficiente
de solubilidad: Se llama coeficiente de solubilidad, al cociente entre
el volumen de gas disuelto y el volumen de solvente, cuando el gas en
contacto con el líquido se halla a la presión parcial de 1 atmósfera
absoluta
Indice
de refracción: de una sustancia o un medio transparente, es la relación
entre la velocidad de la luz en el vacío y la velocidad de la luz en la
sustancia o el medio transparente.
Este
número, mayor que la unidad y sin unidades, es una constante
característica de cada medio y representa el número de veces que es
mayor la velocidad de la luz en el vacío que en ese medio.
El
índice de refracción se mide con un aparato llamado refractómetro en el
que se compara el ángulo de incidencia con el ángulo de refracción de
la luz de una longitud de onda específica Clasificación de la materia
La materia la podemos encontrar en la naturaleza en forma de sustancias puras
y de mezclas.
* Las sustancias puras son
aquéllas cuya naturaleza y composición no varían sea cual sea su estado. Se
dividen en dos grandes grupos: Elementos y Compuestos.
- Elementos: Son sustancias puras que
no pueden descomponerse en otras sustancias puras más sencillas por ningún
procedimiento. Ejemplo: Todos los elementos de la tabla periódica: Oxígeno,
hierro, carbono, sodio, cloro, cobre, etc. Se representan mediante su
símbolo químico y se conocen 115 en la actualidad.
- Compuestos: Son sustancias puras
que están constituidas por 2 ó más elementos combinados en proporciones fijas.
Los compuestos se pueden descomponer mediante procedimientos químicos en los
elementos que los constituyen. Ejemplo: Agua, de fórmula H2O,
está constituida por los elementos hidrógeno (H) y oxígeno (O) y se puede
descomponer en ellos mediante la acción de una corriente eléctrica
(electrólisis). Los compuestos se representan mediante fórmulas químicas
en las que se especifican los elementos que forman el compuesto y el número de
átomos de cada uno de ellos que compone la molécula. Ejemplo: En el agua hay
2 átomos del elemento hidrógeno y 1 átomo del elemento oxígeno formando la
molécula H2O.
|
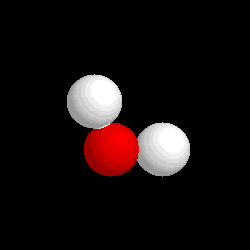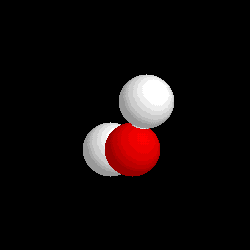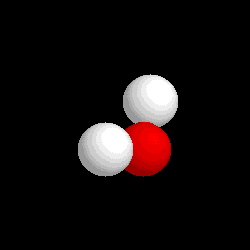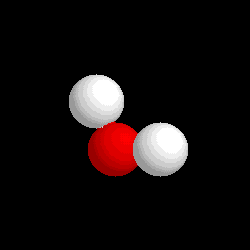 |
Molécula de
agua (H2O), formada por 2 átomos de hidrógeno (blancos) y 1
átomo de oxígeno (rojo) |
|
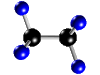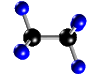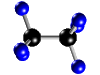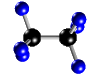 |
Molécula de
etano (C2H6), formada por 2 átomos de carbono
(negros) y 6 átomos de hidrógeno (azul) |
|
 |
Molécula de
butano (C4H10), formada por 4 átomos de carbono
(negros) y 10 átomos de hidrógeno (blancos) |
Cuando una sustancia pura está formada por un solo tipo de elemento, se dice que
es una sustancia simple. Esto ocurre cuando la molécula contiene varios
átomos pero todos son del mismo elemento. Ejemplo: Oxígeno gaseoso (O2),
ozono (O3), etc. Están constituidas sus moléculas por varios átomos
del elemento oxígeno.

Las sustancias puras pueden ser elementos o compuestos,
mientras que las mezclas pueden ser homogéneas o heterogéneas:
|
|
(pulsa en la figura
sobre los nombres de estos 4 tipos de materia para ver sus características)
|
 |
|
|
|